理士蓄电池从本质上来说是一个化学电源,其充电与放电过程其实是一种可逆的化学反应。那么理士蓄电池是怎么储存电能的又是如何工作的呢?


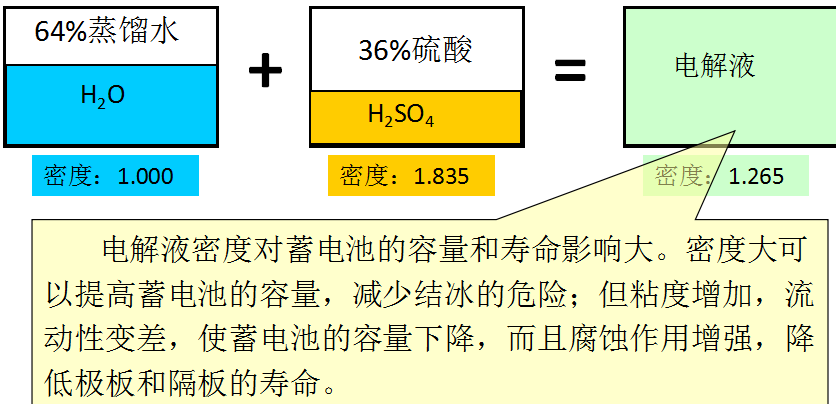
1、电动势的建立
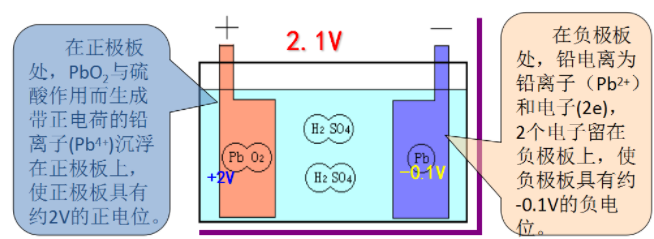
在负极板处,铅电离为铅离子(Pb2+)和电子(2e),2个电子留在负极板上,使负极板具有约-0.1V的负电位。
在正极板处,PbO,与硫酸作用而生成带正电荷的铅离子(Pb4+)沉浮在正极板上,使正极板具有约2V的正电位。
2、理士蓄电池的放电
接上负载后的化学反应
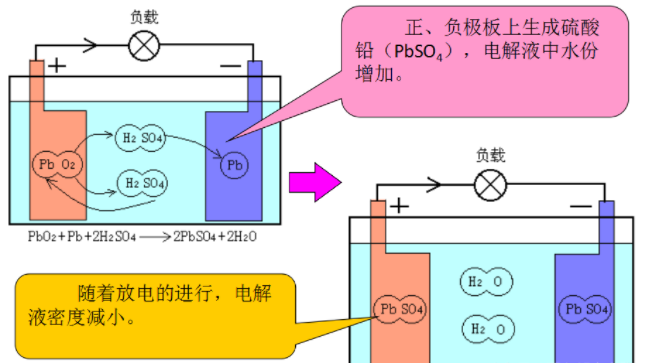
正、负极板上生成硫酸铅(PbSO4),电解液中水份增加。随着放电的进行,电解液密度减小。
负载正、负极板上生成硫酸铅(PbSO4),电解液中水份增加。
随着放电的进行,电解液密度减小。
反应过程如下:Pb02+Pb+2H2S04—>2PbSO4+2H20
3、充电过程
在外电源的作用下,迫使2个电子从正极板返回负极板,形成从正极板流向负极板的充电电流。
极板上的硫酸铅还原成氧化铅和铅,电解液中的水份还原成硫酸。

随着充电的进行,电解液中硫酸的成份增加,电解液密度增大。
反应过程如下:2PbSO4+2H20—>Pb0+Pb+2H2SO4
理士蓄电池的内阻
蓄电池的内阻由极板电阻、电解液电阻、隔板电阻及联条电阻等四部分组成。
极板电阻一般很小,但随着放电的进行,正负极板上的PbSO4增多,极板电阻增大。
电解液电阻与密度和温度有关,密度过高或过低,电阻增大;温度低,粘度大,电阻大。
隔板电阻和联条电阻与材料、联条形式有关,对一个制造好的蓄电池来说是一个定值。
理士蓄电池的放电特性
放电特性是将充足电的蓄电池,在以20h放电率的电流连续放电过程中,端电压U、电动势E和电解液密度γ随放电时间的变化规律。
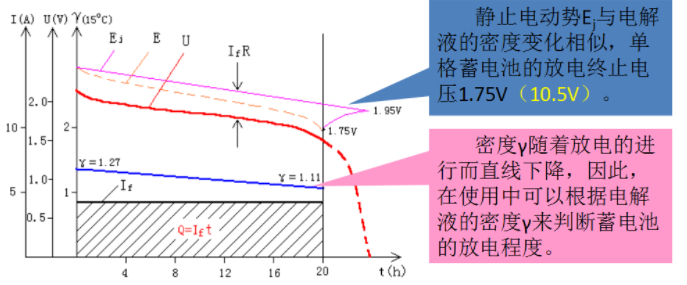
静止电动势E与电解液的密度变化相似,单格蓄电池的放电终止电压1.75V(10.5V)。
密度v随着放电的进行而直线下降,因此,在使用中可以根据电解液的密度v来判断蓄电池的放电程度。
理士蓄电池的充电特性
充电特性是指在恒电流充电过程中,蓄电池的端电压U、电动势E和电解液密度γ随时间变化的规律。
随着充电的进行,电动势逐渐升高,电解液密度增大,充满电后,单格蓄电池的电压为2.1V(12V.6)。
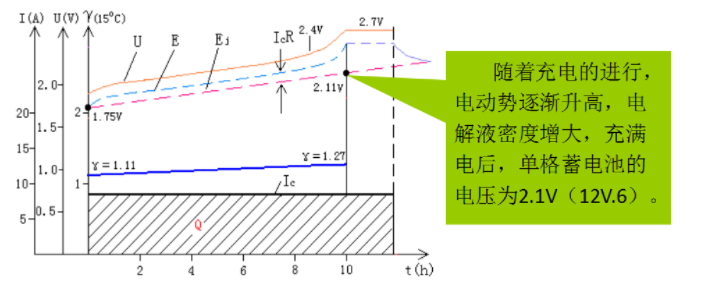
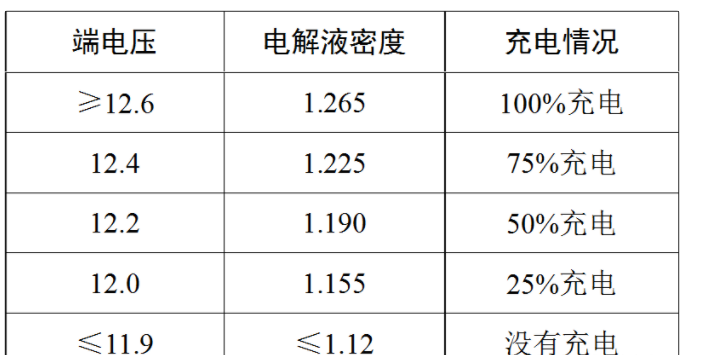
我们可以根据蓄电池的开路端电压的大小,来判断其充电情况: